对化学平衡移动的两种观点的探讨
对中学化学平衡移动的方向问题,基本上有两种观点,对大多数化学反应来说,这两种观点对平衡移动的方向的讨论是一致的,但对某些类型的化学反应,如在醋酸溶液中加入冰醋酸,对反应CH3COOHCH3COO-+H+的平衡移动方向的问题,他们有不同的看法,一种观点认为,由于加入冰醋酸后,醋酸的转化率(或者产物的百分含量)降低,故平衡应该向左移动;另一种观点认为,由于加入冰醋酸后,反应物CH3COOH的浓度增加,根据勒夏特列原理,平衡应该向右移动。我把第一种观点称为状态论,第二种观点称为过程论,下面我总结概括了这两种观点的基本思想、判据、中学应用中学生的困惑、两种观点的成因等几个方面的问题,最后谈谈自己的看法。
首先谈谈两种观点的基本思想和内容:
状态论:状态论认为,化学平衡移动的方向只和化学反应的始终态有关,而与反应的过程无关,一旦确定了化学反应的始态和终态,化学反应的方向就确定了。比如,一旦确定了A、B、C三种平衡状态,如图所示,
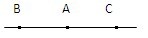
从A平衡状态到B平衡状态就只有一种方向,平衡向左移动,从A平衡状态到C平衡状态也只有一种方向,平衡向右移动,平衡移动的方向与途径没有关系。状态论还认为,化学平衡移动的方向与化学反应的方向不一定一致,如,有可能出现化学反应向右进行,但化学平衡却向左移动的时候。
过程论:过程论认为,化学平衡移动的方向与反应的过程有关,如图所示,

从平衡状态A改变条件到平衡状态B,有多种途径,如可以A→C→B,也可以A→D→B,考虑平衡移动的方向应该从改变条件使平衡状态A变为非平衡状态C或D时开始考察平衡移动问题,若改变条件的瞬间,非平衡状态C在平衡状态B的左边,则平衡向右移动达到平衡,若改变条件的瞬间,非平衡状态D在平衡状态B的右边,则平衡向左移动达到平衡。过程论认为,平衡移动的方向与反应的方向一致。
两种观点又是根据什么来判断平衡移动的方向的呢?
状态论:对平衡移动方向的绝对判据,持状态论者又有两种观点。一种认为,要根据产物的百分含量或比率判断(也可以根据反应物的百分含量判断),若产物的百分含量或比率增大,平衡向右移动,若产物的百分含量或比率减少,平衡向左移动。还有一种观点认为,要根据反应物的转化率判断,若反应物中只要有一种物质的转化率增大,平衡向右移动。但持这两种观点者又经常用勒夏特列原理来判断平衡移动的方向,一旦和勒夏特列原理产生矛盾,他们认为还是以他们的绝对判据为准。
过程论:过程论认为,判断平衡移动的根本判据是勒夏特列原理,但化学反应中正逆反应速率的比较也可以判断平衡移动的方向,若ν正>ν逆,平衡向右移动,ν正<ν逆,平衡向左移动,ν正=ν逆 ,平衡不移动。过程论认为,还可以通过浓度熵QC(或Qp)和化学平衡常数K来判断平衡移动的方向,若QC>K,平衡向左移动,若QC<K,平衡向右移动,若QC=K,平衡不移动。
有关学生的困惑集中体现在状态论中。以本文中开头举的例子为例,过程论的勒夏特列原理判据,反应速率判据,浓度熵判据都是统一的,没有让学生产生困惑,但状态论的观点让学生产生了以下疑问:
1、增加醋酸浓度,ν正>ν逆,平衡应该向右移动,与状态论矛盾。
2、根据QC<K,平衡向右移动,与状态论矛盾。
3、根据勒夏特列原理,增加反应物浓度,平衡向右移动,状态论却说向左移动,为什么两种判据不一致?
对第1、2点疑问,状态论有合理的解释:反应速率和浓度熵只能说明反应的方向,不能判断平衡移动的方向,平衡移动的方向和反应的方向不一定一致。第3点疑问是状态论的软肋,我到现在还没看到状态论者有一个合理的解释,由于中学是以勒夏特列原理来判断平衡移动的方向的,你总不至于说勒夏特列原理有问题啊。而学生对状态论难以理解的原因是,平时持状态论的老师解题时,没有哪一位老师在判断平衡移动的方向的时候每次都去计算了反应物的转化
[1] [2] [3] [4] 下一页
