氧化-还原反应是中学化学很重要的知识内容,它涉及的概念多,且易混淆。因此准确地理解概念的涵义,明确概念间的内在联系和实质区别,对应用和运用氧化-还原反应知识解决实际问题,是十分有利的。
氧化-还原反应所涉及的概念主要有氧化、还原、氧化剂、还原剂、氧化性、还原性、氧化产物、还原产物等。
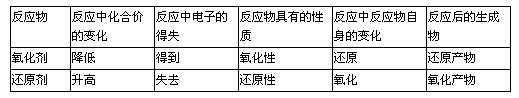
1.氧化-还原反应中
氧化通常指原子或离子失电子或电子对偏离(使元素的化合价升高)这个过程。
还原通常指原子或离子得电子或电子对偏向(使元素的化合价降低)这个过程。它们是在同一反应中的两个相反方面,它们必然相伴而生,得失电子的过程必然同时进行。
2.氧化剂是指得电子的原子或离子;得电子的物质(或供给氧的物质)。
还原剂是指失电子的原子或离子,失电子的物质(或接受氧的物质)。
在氧化-还原反应中,氧化剂与还原剂是反应物中处于同一反应过程中相“对立”的两种物质,靠得失电子完成反应,且得失电子总数相等。
3.氧化性是指某物质(离子或原子)可作为氧化'剂的性质。
还原性是指某物质(原子或离子)可作为还原剂的性质。物质的氧化性或还原性只有在具体反应中才能反映出来,并在与具体物质相比较时才能确定其强弱。
4.氧化产物是指还原剂(原子或离子)失去电子(被氧化)后生成的物质(原子或离子)。
还原产物是指氧化剂(原子或离子)得到电子(被还原)后生成的物质(原子或离子)。它们是通过氧化剂和还原剂反应后生成的不同产物。
列表归纳如下;